Hyper prolactinemia:
هايپر پروالکتينمي يکي از انواع hyper secretionهاي هيپوفيز است . هايپر پروالکتينمي ميتواند همراه با پروالکتينوما باشد يا نباشد.
حاال راجع به خود پروالکتين :
پروالکتين ، هورموني شامل ??? آمينواسيد و داراي وزن مولکولي حدود ????? کيلودالتون ميباشد . از نظر ساختاري شباهت به GH و HPL ( h placental lactogen) يا الکتوژن جفتي انساني دارد.
اين شباهت ها بيان کننده ي اشتراک احتمالي هر سه ي اينها از يک ژن است. پروالکتين در سلول هاي الکتوتروپ سنتز و ترشح ميشود که حدود ??% سلول هاي هيپوفيز قدامي را تشکيل ميدهد.
سطح سرمي نرمال پروالکتين در بالغين : در خانم ها ??-?? ميکروگرم/ ليتر يا نانوگرم /ميلي ليتر)
در آقايان ??-?? ميکروگرم/ليتر)
پروالکتين هورمون شايعي است و به تبع آن ، تومور سلول هاي الکتوتروپ ، شايع ترين تومور هيپوفيز است و در خانم ها نيز شايع تر است. ترشح پروالکتين نيز مانند ساير هورمون هاي هيپوفيز به صورت ضرباني يا pulsatileاست. حداکثر ترشح در طي خواب REMاتفاق ميافتد و حتي تا ?? ميکروگرم/ليتر نيز ميتواند برسد.) در حدود ساعت ?تا? صبح(
نيمه عمر اين هورمون حدود ?? دقيقه ميباشد.
پروالکتين تنها هورموني است که هيپوتاالموس با روش مهاري آن را تنظيم ميکند. ) به واسطه ي دوپامين مترشحه از هيپوتاالموس که سنتز و ترشح پروالکتين و ترشح پروالکتين از هيپوفيز قدامي را با تاثير بر گيرنده هاي D2در سلول هاي الکتوتروپ تنظيم ميکند(
TRHنيز يکي از فاکتورهاي هيپوتاالموسي است که تنظيم ترشح TSH را برعهده دارد و ازاين طريق در آزاد شدن LRP نقش دارد.
در شکل زير به صورت شماتيک تاثير عوامل گفته شده را بر ترشح پروالکتين ميبينيد . )فاکتورهاي مهاري و تحريکي(
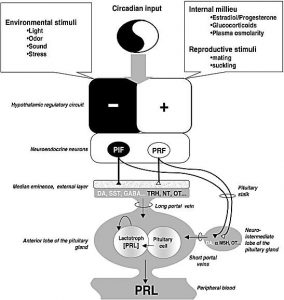
دوپامين همانطور که گفته شد از عومل مهاري است که از طريق ساقه ي هيپوفيز يا همان stalk به هيپوفيز قدامي ميرسد و ياعث مهار ترشح پروالکتين ميشود.
عاملي که باعث آسيب ساقه ي هيپوفيز شود و مانع از انجام اثرات مهاري گفته شده ي دوپامين شود ميتواند باعث افزايش آزاد سازي پروالکتين از هيپوفيز شود.
از عوامل مهاري ديگر براي پروالکتين ، کورتون ها )گلوکوکورتيکوئيدها( و هورمون هاي تيروئيدي هستند.
براي مثال : اگر کسي کم کاري تيروئيد داشته باشد که درمان نشده باشد به دليل فيدبک هورمون هاي تيروئيدي کاهش ياقته بر هيپوتاالموس و هيپوفيز ، TRH افزايش يافته و منجر به افزايش پروالکتين ميشود. پس ما اگر اينجا هورمون تيروئيدي بدهيم ،اين هورمون اثر مهاري بر ترشح افزايش يافته ي پروالکتين خواهد داشت و به سطح نرمال برگردانده ميشود.
پپتيد وازواکتيو VIP از پپتيدهاي روده اي است که ميتواند در تحريک ترشح پروالکتين نقش داشته باشد .
عمل پروالکتين :
کار اصلي پروالکتين در سنتز و ترشح شير است
عملکرد ضد توليدمثلي) کاهش rate باروري و) reproduction
کاهش libido و تمايل جنسي )sexual drive)
نحوه عملکرد ضد توليدمثلي :PRL
از طريق تاثير بر هر دو site مرتبط با محور جنسي يعني محور هيپوتاالموس- هيپوفيز-گناد
• مهار شدن Gnrhو کاهش ترشح گنادوتروپين ها از هيپوفيز
• نقص در استروئيدوژنز در گنادها در هر دو جنس ) يعني اختالل در سنتز تستوسترون و استراديول (
پروالکتين در تخمدان ميتواند باعث مهار فوليکولوژنز
و مهار فعاليت آروماتاز شود. آروماتاز آنزيمي است که ميتواند باعث تبديل آندروژن به ترکيبات استروژن شود.
مهار آروماتاز :
• کاهش سطح استروژن ) هايپو استروژنميا (
• عدم تخمک گذاري
پروالکتين همچنين داراي اثر luteolytic ميباشد يعني فاز لوتئال را کوتاه ميکند و باعث کوتاه شدن يا بي نظمي دوره ي menstrual و کاهش باروري و شانس باروري در بيمار ميشود.
در آقايان نيز اين مسئله هست و تاثيرش را با ?( کاهش سطح LDH و درنتيجه کاهش سطح تستوسترون و به دنبال آن کاهش libido و ميل جنسي و همچنين ?( کاهش اسپرماتوژنز و شانس fertility نشان ميدهد .
همانطور که گفتيم hyper prolactinemia شايعترين hyper secretion هيپوفيزي است ) هم در خانمها و هم در آقايان (
وضعيت هاي فيزيولژيک مرتبط با ( hyper prolactinemia ممکن است اتيولوژي هايپر پروالکتينمي بيماري زا يا پاتولژيک نباشد و وضعيت هاي فيزيولژيک خاصي نيز مرتبط با اين موضوع هستند ( :
?- : Pregnancy در حاملگي سطح prl حتي تا ?? برابر حد نرمال افزايش ميابد .
پس در هنگام مشاهده ي هايپر پروالکتينمي در يک خانم ، اولين کار، رد کردن يا rule out حاملگي است .
?- در وضعيت هاي مرتبط با استرس ، تغذيه و رابطه ي جنسي نيز ميتواند باعث افزايش سطح prl سرم شود .
?- پس ابتدا بايد اين شرايط فيزيولژيک رد شود و سپس آزمايش درخواست شود که به صورت ناشتا و در صبح و در شرايط بدون استرس بايد انجام شود.
نکات مربوط به جدول اتيولوژي :
گفتيم يک سري مسائل فيزيولژيک ميتوانست باعث باال رفتن سطح prl شود. همچنين آسيب به ساقه ي هيپوفيزي و برداشته شدن اثر مهاري دوپامين بر سلول هاي الکتوتروپ ، تومورهاي مجاور هيپوفيز و هيپوتاالموس که اثر فشاري بر stalk هيپوفيز ايجاد ميکنند، مواردي که به عنوان empty sella مطرح ميشوند که يعني زين ترکي خالي و در اثر تروماهاي قبلي و يا آپوپلکسي ناشي از تومور قبلي که باعث تحليل رفتن هيپوفيز و پر شدن قسمتي از زين ترکي با csf ميشود ، ايجاد ميگردد، التهاب هاي لنفوسيتي هيپوفيز و ….
اتيولوژي هاي ديگر شامل مواردي است که خود سلول هاي الکتو تروپ ، افزايش توليد پروالکتين را دارند به دليل ايجاد تومور که اصطالحا به آن پروالکتينوما گفته ميشود .
همچنين آکرومگالي مخصوصا در مواردي که ميکس با الکتوتروپ هستند ميتواند با افزايش سطح prl همراه باشد .
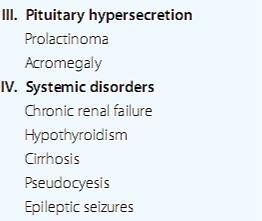
عوامل مرتبط ديگر : نارسايي مزمن کليه ، هايپوتيروئيدي ، سيروز و …
در مواردي که سطح prl افزايش قابل توجهي دارد ) بيشتر از ??? نانوگرم/ميلي ليتر ( ، به احتمال زياد علتش تومور ) آدنوم ( هست .
در مقادير کمتراز??? ، ميتواند ، ولي بايد اول مسائل ديگر را تومور باشد)ميکروآدنوم ( rule out کنيم .

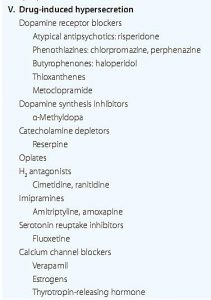
خيلي از داروها ميتوانند باعث افزايش سطح prl شوند :
داروهايي که اثرات مهاري روي ترشح دوپامين يا برگيرنده ي دوپامين دارند ، مثل داروهاي آنتي سايکوتيک ) چه قديمي ها مثل haloperidol و چه داروهاي جديد مثل risperidone که مهمترين و شايعترين داروهاي مسبب هايپر پروالکتينمي است و ميتواند حتي تا ?? برابر سطح نرمال ، آن را باال ببرد ( ، داروهاي مهارکننده ي گيرنده ي D2 مثل metoclopramide ، داروهاي مهارکننده ي سنتز دوپامين مثل متيل دوپا ، داروهاي مهار کننده ي H2 مثل رانيتيدين و سايمتيدين ، opiate ها ، C سري ها مثل amoxapine و ( amitriptyline منظور از C سري احتماال category C pregnancy است( ، داروهاي )selective serotonin reuptake inhibitor (SSRI مثل fluoxetine و )calcium channel blocker (CCB ها که کاربرد زيادي هم دارند ميتوانند باعث افزايش سطح prl شوند .
به غير از risperidone، بقيه تقريبا افزايش هاي خفيف prl را به دنبال دارند ) يعني کمتر از ??? (
در مقادير پايين سطح prl اول بايد دنبال اتيولوژي هاي غير از تومور بگرديم که دارئها سردسته ي اين عوامل هستند و بقيه ي عوامل شامل وضعيت هاي فيزيولوژيک و اثر هاي فشاري با داليل مختلف بر stalk هيپوفيز .
همه ي هايپر پروالکتينمي ها به خاطر پروالکتينوما نيستند.
• ميکرو پروالکتينوما ) ميکرو آدنوم ترشح کننده ي )prl
داراي سايز کمتر از ?? ميلي متر است واي پروالکتينوما ميتواند سايزهاي بزرگتري هم داشته باشد که ساختار هاي اطراف را تحت تاثير قرار دهد . ) اثرات local و ) focal
نسبت female – to – male ميکروپروالکتينوما تقريبا ?? به ? است .
در مورد ماکرو آدنوم ها ) > ?? ميليمتر ( نسبت تقريبا يک به يک است .
مردان نسبتا تومورهاي بزرگتري دارند . به داليلي مانند توجه کمتر مردان به عالئم و تظاهرات و همچنين اين که يکي از مهم ترين تظاهرات در خانم ها که گاالکتوره ميباشد ) ترشح شير ( ، در آقايان نادر است و تومور خودش را دير نشان ميدهد . ) با کاهش libido و ميل جنسي و کاهش باروري( حدود 5% ميکرو آدنوم هاي پروالکتين ميتواند در طوالني مدت بزرگتر شده و به ماکرو آدنوم تبديل شود .
سايز تومور با ميزان ترشح prl تناسب دارد و غلظت هاي باالي prl بيشتر در ماکرو پروالکتينوما ها قابل مشاهده است .
گفتيم تومورهاي mixed ميتوانند به صورت پروالکتين و GH يا ACTH و پروالکتين ونيز به ندرت TSH و prl وجود داشته باشند . اين موارد که چند هورموني هستند خيلي وقت ها در illness بيمار مشخص نميشود . با بررسي هاي پس از جراحي متوجه mixed بودن آن ميشوند .
Hall mask هاي تشخيصي هايپر پروالکتينمي در زنان شامل آمنوره ، گاالکتوره ) در 80% موارد ( و infertility است.
اگر اين وضعيت درمان نشود و ادامه پيدا کند ، ساير تظاهرات نيز کم کم بروز مي يابند مثل هايپواستروژنميا که روي دانسيته ي استخوان ها اثر دارد و يکي از فاکتور هاي دخيل در تراکم استخوان محسوب ميشود و يک عامل آنابوليک است .
هايپر پروالکتينمي ميتواند از اين طريق باعث کاهش دانسيته و تراکم استخوان بيماران شود . به همين دليل هم هست که در خانمي که يائسه شده است بايد هرچند وقت يکبار با دانسيتومتري ، تراکم استخوان چک شود و اگر score پائين ) ?- به پائين ( داشته باشد ، انديکاسيون درماني استئوپروز را مطرح ميکند .
از عوارض ديگر : کاهش libido و infertility هست ولي چون تومورها سايز بزرگتري دارند ، همراه با اثرات local و focal بر قسمت هاي کناري مثل optic chiasma است که ممکن است با کاهش بينايي يا حتي ايجاد visual loss بروز يابد و بايد به چشم پزشک ارجاع داده شوند .
گاالکتوره در مردان به ندرت اتفاق مي افتد .
اگر هايپر پروالکتينمي ادامه داشته باشد اثرات ثانويه هايپوگناديسم نيز ميتواند ظهور يابد که شامل osteoperi ، کاهش mass عضالني و کاهش رشد موهاي صورت ميباشد .
در هر دو جنس تومور ميتواند باعث کاهش visual field و ايجاد سردرد شود .
پس بعد از تشخيص پروالکتينوما بايد بيمار را براي بررسي ميدان ديد ارجاع دهيم .
آزمايش بايد در وضعيت ناشتايي و بدون استرس با خواب کافي ، بدون رابطه ي جنسي و تحريک breast صورت گيرد .
در خانم ها آزمايش pregnancy در وهله اول بايد حتما درخواست شود تا حاملگي را rule out کنيم .
شرح حال دارويي خيلي مهم است و همچنين هايپو تيروئيدي نيز بايد rule out شود و در نهايت درخواست MRI ميکنيم .
اگر واقعا هايپر پروالکتينمي داشته باشيم حتما بايد MRI صورت گيرد حتي در مقادير کمتر . چون ممکن است اين هايپر پروالکتينمي به خاطر اثر فشاري يه توده بدخيم در مجاورت هيپوفيز ايجاد شده باشد .
درمان :
فارماکوتراپي : به وسيله ي آگونيست هاي دوپامين ) به دليل اثر مهاري بر سلول هاي الکتو تروپ ( که هم کيتواند باعث کاهش ترشح prl توسط سلول ها شود و هم اين که رشد و تکثير سلول ها را کاهش دهد يا حتي تومور را shrinkage کند.
حدود 20% از بيماران ، به خصوص مردان که گفتيم پروالکتينوما هاي بزرگتري دارند ممکن است مقاوم به درمان هاي آگونيست دوپامين شوند .
ممکن است گيرنده ي D2 در تومور کم باشد يا اينکه اشکاالت post رسپتوري داشته باشند که باعث عدم انتقال سيگنال گيرنده شود و اثري روي کاهش prl و proliferation ايجاد نشود .
از داروهاي آگونيست دوپامين ، bromocriptine را داريم که اثرش روي گيرنده ي D2 است و با دوز کم و در شب تجويز ميشود .
داروي بعدي cabergoline است که اين هم با دوز کم ) حدود .0? ميليگرم به صورت دوبار در هفته ( شروع ميشود تا به سطح نرمال prl برسيم و اگر نرسيديم در follow up، دوز
را افزايش ميدهيم .
تا 80% افراد دچار ميکرو آدنوم ممکن است function طبيعي گنادها را بازيابند.
گاالکتوره نيز در حدود 90% بيماران رفع ميشود .
کابرگولين باعث نرمال شدن سطح prl ميشود و تا حدود 70% ميتواند ماکرو پروالکتينوما را کوچک کند.
ممکن است فردي به يکي از اين دو دارو مقاوم باشد يا اصال تحمل مصرف را نداشته باشد که اينجا ميتوانيم جايگزين کنيم ولي به طور کلي با توجه به side effect هاي کمتر cabergoline و قدرت اثر گذاري بيشتر آن ، ما اين دارو را به عنوان خط اول درمان در نظر ميگيريم مگر اينکه فردي براي pregnancy پالن داشته باشد . چون هر دوي اين داروها براي pregnancy کنترا انديکه است ولي بر طبق مطالعات انجام شده ، bromocriptine را در اين مورد ترجيح ميدهند که فرد قبل از pregnancy با مصرف اين دارو دچار سيکل هاي منظم عادت ميشود که بتواند تشخيص دهد که چه زماني باردار شده است . bromocriptine را از ?ماه قبل از بارداري شروع ميکنيم و به محض اينکه بارداري اتفاق افتاد ، دارو قطع ميشود و مريض فقط follow up ميشود از جهت اين که آيا عوارض مربوط به تومور مثل سردرد هاي شديد و اختالالت ميدان بينايي ايجاد شده يا نه . ) در مورد macro prolactinoma ها بهتر است که ويزيت چشم پزشکي هم صورت بگيرد (
دو نمودار زير اثر ? داروي bromocriptine و carbagoline را نشان داده است . همانطور که ميبينيد سطح prl در کساني که کابرگولين مي گرفته اند به صورت significant نسبت به گروه ديگر بيماران که bromocriptine دريافت مي کرده اند پايين تر آمده ) کمتر از ?? نانوگرم بر ميلي ليتر( ولي در مورد bromocriptine تا باالي ?? هم بماند و پايين تر نيايد

در شکل زير يک ماکروپروالکتينوما در حد ?-4 سانتي متر ميبينيد که invasion پيدا کرده به سينوس کاورنوس وحتي به optic chiasma که آن را به اطاق چسبانده و در پائين هم extension پيدا کرده به قسمت سينوس اسفنوئيد .
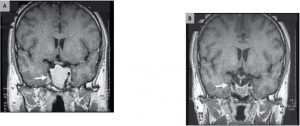
همانطور که ميبينيد پس از درمان تومور بسيار کوچکتر شده و optic chiasma کامال آزاد شده و از پايين هم مقداري جمع شدگي پيدا کرده و اطراف سينوس کاورنوس هم تا حدي از تومور آزاد شده است .
پس ميتوان گفت تومور هيپوفيز تنها توموري است که درمان دارويي براي آن ، choice درماني محسوب ميشود . پس در سواالت اقدام اول براي اين تومور ها medical therapy است نه surgery
انديکاسيون هاي جراحي در مواردي است که درمان دارويي شروع شده و عدم تحمل يا اصال عدم پاسخگويي به درمان داريم .
و همچنين در موارد invasive که تومور به شدت رشد کرده ) مثل شکل قبلي ( و بيمار دچار اختالل بينايي شده و
امکان visual loss وجود دارد ، جراحي قدم اول است .
پس از جراحي ، دستيابي به سطح prl نرمال در مورد ميکرو آدنوم ها تا 30% ميباشد .
درمان medical حتي براي بيماراني که جراحي ميشوند نيز بايد قرار داده شود تا suppress prl شود و مانع عود تومور شويم .
راديوتراپي : در مورد تومور هاي aggressive که حتي با جراحي هم کامال برداشته نشده ، اين کار انجام ميشود تا بقاياي تومور هم از بين برود.
اين هم الگوريتم management يک صحبت هاي گفته شده است . هدف ، است .
prl باالست که تقريبا همان رساندن prl به کمتر از ??
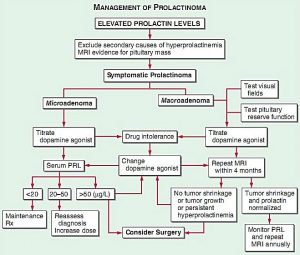
پس از قرار دادن medical therapy حتما follow up بيمار را انجام ميدهيم که به صورت MRI ميباشد و پس از مدتي بايد shrinkage تومور را مشاهده کنيم و اگر اين اتفاق نيوفتد چاره اي جز جراحي نيست .
: Posterior hypophysis
ادامه ي آکسون هاي بطن سوم مغز قسمت خلفي هيپوفيز را تشکيل ميدهد . اين قسمت ? هورمون ترشح ميکند : ( AVP )arginine vasopersin يا همان ADH و اکسي توسين .
اکسي توسين بيشتر در مبحث زنان و زايمان کاربرد دارد و عامل انقباض عضالت رحمي و عضالت مرتبط با شيردهي است اما AVP اثرات سيستميک بيشتري دارد و هورموني است که در تنظيم آب و الکتروليت نقش دارد و در صورت کمبود ، ميتواند complication ها و حتي عوارض مرگ آور داشته باشد.
ساختمان مولکولي اين ? هورمون را در اين شکل ميبينيد که شباهت خيلي نزديکي به هم دارند . تفاوت آنها در جايگزيني Arg و لوسين و همچنين فنيل آالنين است .
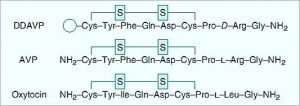
پس اين ? هورمون در اجسام سلولي هيپوتاالموس ساخته ميشود ولي release در هيپوفيز خلفي اتفاق مي افتد .
دارويي داريم به نام ddAvp که در واقع همان AVP است که به صورت سنتتيک ساخته شده و گروه آمينش برداشته شده . ) در مورد اين دارو بعدا بيشتر توضيح خواهيم داد (
همانطور که گفته شد ADH در تنظيم آب و الکتروليت نقش دارد و عمده ترين اثرش را با تاثير بر مجاري جمع کننده اعمال ميکند و باعث بازجذب آب از اين مجاري ديستال ميشود . در مجاري جمع کننده به دنبال جذب آب و الکتروليت ها ، حجم ادرار کاهش و غلظت و اسموالريته آن افزايش ميابد .
از طرف ديگر اسموالريته ي پالسما نيز کاهش ميابد .
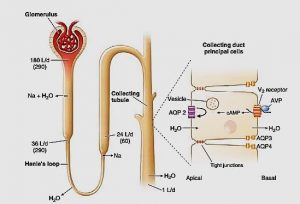
اثر ديگر اين هورمون ، اثر vasoconstriction آن است و ميتواند باعث افزايش فشار خون شود . اما اثري مقابل اين اثر هم دارد که ميتواند فشارخون را تعديل کند و آن اثري است که روي قلب گذاشته و باعث برادي کاردي مي شود و مهار فعال شدن سيستم سمپاتيک را نيز به دنبال دارد .
اين ها مقدمه اي از اثرات AVP بود .
: Diabetis incipidus
تنها شباهت اين ديابت با ديابت واقعي ، مسائل پر ادراري و شب ادراري است . ولي فيزيوپاتولوژي آن ها کامال باهم متفاوت است .
در مورد ديابت incipidus ، دو اتيولوژي اضلي ميتوانيم در نظر بگيريم :
?- Central يا neurogenis
?- Nephrogenic
در مورد central ، AVP اي که قرار است در هيپوتاالموس سنتز شود و در posterior pituitary ترشح شود ، ترشح نميشود و به تبع آن کاهش اثر هورمون ADH را ميبينيم .
در مورد nephrogenic ، هورمون ADH را داريم ولي اثرش را روي جايگاه اثرش يعني مجاري جمع کننده اعمال نميکند و ايتولوژي هاي مختلفي دارد ) از مسائل ارثي و نبود گيرنده تا اختالالت ساختماني (
يک فرم از DI هم داريم به عنوان getational DI که مرتبط با pregnancy است که در بعضي از خانم هاي pregnant ممکن است مشکالت پر ادراري و شب ادراري ديده شود . به اين دليل که يک آمينوپپتيدازي از جفت ترشح ميشود که AVP را تخريب ميکند و تاثيري شبيه central DI را ممکن است ايجاد کند .
يک نوع DI ديگر هم هست به نام dipsogenic DI که در اين نوع ، مسائل psychiatry بيشتر مطرح است و اشکال در موارد گفته شده قبلي نيست و اين نوع ديابت مورد بحث ما نيست .
اتيولوژي : central DI ميتواند شامل موارد اکتسابي مثل تروماي سر ، تومور ها و آسيب هايي که به هيپوتاالموس وارد شده ) به هر طريقي ( و آدنوم هاي خود هيپوفيز که اثر تخريبي روي هيپوتاالموس گذاشته ، بعضي بيماري هاي ارتشاحي مثل تيستو سايتوزيس ، ديس ژرمينوم ها ، عفونت هاي مزمن مثل انسفاليت ويروسي و توکسوپالسموز و مننژيت مزمن که همه اين ها ميتواند به قسمتي از هيپوتاالموس و يا هيپوفيز خلفي صدمه وارد کند . علت هاي التهابي مثل لوپوس ، سارکوئيدوز ، اسکلرودرما و همچنين توکسين هايي که روي نوروهيپوفيز ميتوانند تاثير بگذارند و همچنين lymphocytic infundibulo neurophysis و سندروم Sheehan که وضعيتي است که در خانم هاي حامله که خونريزي شديد اتفاق افتاده و باعث هايپوتنشن شديد شده ، هيپوفيزش دچار آسيب ايسکميک شده و ممکن است دچار هايپو سکرشن و تخريب هيپوفيز شود .
مسائل عروقي مثل aneurism و اتيولوژي هاي ديگر مثل مسائل congenital و موارد ديگر جدول .

در مورد اتيولوژي gestational DI هم مواردي مثل حاملگي هاي دوم و سوم ، سارکوما و ارتشاح ميتوانند دخيل باشند .
اتيولوژي : nephrogenic DI
موارد اکتسابي مثل داروهايي از قبيل ليتيم ، demeclocycline
، methoxyflurane ، amphotericine B و ساير موارد . مسائل متابوليک مثل هايپرکلسمي و هايپر کلسي اوري.
Obstruction هايي که طوالني مدت بوده که بعد از اصالح آن امکان ايجاد NDI وجود دارد.
بيماري عروقي مثل sicklecell و ايسکمي هاي توبوالر نکروزيس و گرانولوم هايي مثل سارکوئيدوز و الي آخر …
و اما در مورد اتيولوژي primary polydipsia که گفتيم بيشتر مسائل psychiatry مطرح است شامل موارد شيزوفرني ، OCD و موارد ديگر که در جدول آمده است ، ميباشد . در اين مورد استفاده از ddAVP ميتواند خطرناک باشد و درمان اين گروه بيماران سخت است .
تشخيص افتراقي :
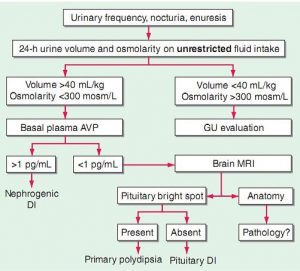
تشخيص اوليه بر پايه ي جمع آوري ادرار ?? ساعته و بافته
ي پلي اوري است. اين که فرد بيمار بگويد زياد به دستشويي ميرود ) تکرر ادرار ( خيلي تشخيصي نيست و مسائل عديده ي ديگري هم ميتوانند مطرح باشند ) از مسائل مربوط به مثانه تا عفونت ها (
پس از جمع آوري ادرار ?? ساعته اگر حجم ادرار بيشتر از 50cc/kg باشد ، تعريف پلي اوري است. ) حدود ) 3500cc
در اين وضعيت پلي اوري اگر اسموالريته ي ادرار هم کمتر از 300 mos باشد ميتوان گفت فرد دچار DI هست. يعني بيمار علي رغم اين که ادرار زيادي دفع ميکند ، با توجه به اسموالريته ي ادرار ، اين دفع زياد ناشي از وجود اسمول ها در ادرار نيست ) يعني ديابت در اينجا ناشي از وجود يک اسمول مثل گلوکز در ادرار نيست که آب را هم با خود کشيده باشد و ايجاد پلي اوري کند ( پس از تشخيص DI بايد ببينيم اتيولوژي چيست ، مربوط به central است يا نفروژنيک . براي اين کار تستي وجود دارد به نام water deprivation که در آن ، بيمار را مدتي ) ??ساعت ، ?? ساعت حتي چند روز يا کمتر يا بيشتر ( تحت بستري و observation قرار ميدهند و فرد را از نوشيدن و خوردن محروم ميکنند و به صورت هر ? ساعت حجم ادرار ، اسموالريته ي ادرار ، سديم پالسما ، اسموالريته ي پالسما ، فشار خون و وزن چک ميشود و در يک chart ثبت ميشود.
در حالت طبيعي در صورت محروميت از آب و به دنبال آن کم شدن حجم پالسما ، مکانيسم هاي فيدبک فعال شده و باعث ترشح AVP ميشود که در نهايت منجر به بازجذب آب و افزايش اسموالريته ي ادار ميشود . ولي در حالت DI ، اسموالريته ي ادرار تغيير چنداني نميکند و طي هر ?ساعتي که وضعيت چک ميشود، اسموالريته ي ادرار و حجم ادرار تغييرات اندکي دارند و هم چنان اسموالريته ي ادرار پائين است.
در واقع در صورتي که طي ? دوره ي ?ساعته افزايش اسموالريته ي ادرار کمتر از 30 mos باشد يعني به حالت platealle رسيده که در اين هنگام تست را قطع ميکنيم و بررسي بعدي را براي تعيين نوع DI انجام ميدهيم .
بررسي بعدي تجويز ddAVP است . اگر پس از تجويز ddAVP پاسخ به درمان داده شود ، يعني حجم ادرار کاهش يافته و اسموالريته ي آن افزايش يابد ) بيشتر از 50% (به معني central DI است ولي اگر همچنان پاسخي مشاهده نشود ، مشکل nephrogenic مي باشد .
عالوه بر اين تست محروميت از آب ، کار ديگري که ميتوان انجام داد اندازه گيري سطح پايه ي AVP پالسماست.
در مواردي که AVP پالسما باالي 1pg/ml است ،nephrogenic DI و اگر کمتر از 1pg/ml باشد از MRI استفاده ميکنيم و اگر MRI اشکال آناتوميک خاصي نشان دهد بايد دنبال پاتولوژي بگرديم . يک bright spot در هيپوفيز خلفي در . MRI هيپوفيز سالم بايد ديده شود که وقتي نباشد تخريب هيپوفيز خلفي مطرح است و بايد به central DI شک کرد ، ولي اگر وجود داشته باشد نشانه ي سالم بودن هيپوفيز خلفي است و مطرح کننده ي اتيولوژي غير ارگانيک و غير structive هيپوفيز ميباشد .
با وجود تمام راه هاي تشخيصي که گفته شد ممکن است مواردي باشند که partial باشند و نقص هم در central و هم در nephrogenic باشد و در اينجا اين راه ها ممکن است پاسخگوي تشخيصي نباشند و در اين حالت از خود دسموپرسين استفاده ميکنيم و درمان trial انجام ميدهيم يعني تجويز ميکنيم و ميبينيم که به درمان پاسخ ميدهد يا نه .اين کار بهتر است تحت نظر و در بيمارستان باشد ، چرا که در صورتي که بيمار primary polydipsia DI باشد ، باعث هايپوناترمي و مسموميت ميشود . پس بايد بيمار تحت close monitoring و اندازه گيري سديم و اسموالريته ي پالسما و مقادير مربوط به ادرار باشد .
درمان :
درمان همان ddAVP است که به صورت انتخابي روي گيرنده ي V2 اثر ميگذارد و باعث قرار گرفتن کانال هاي آکواپورين
? در قسمت راسي و کشيدن آب از لوله ها به داخل سلول هاي توبولي شود و از طريق آکواپورين ? و ? که در vasobasal توبول است ، مايع را به خارج توبول هدايت کند .
فرم هاي ddAVP به صورت استنشاقي و حتي خوراکي IV ، )subcutaneous ( SCو فرم به صورت قرص وجود دارد .
فرمي که بيشتر استفاده ميشود فرم استنشاقي است. ) با دوز 10-20 ميکروگرم/ روز ( درمان موارد primary polydipsia خيلي سخت است و با ddAVP امکان پذير نيست.در اين موارد از داروهاي anti-diuretic استفاده ميشود که خيلي هم کمک کننده نيست . در اين بيماران همانطور که گفته شد بايد مسئله ي مسموميت با ddAVP و آنتي ديورتيک ها مورد توجه قرار گيرد.
درمان موارد nephrogenic نيز با ddAVP صورت نميگيرد و با استفاده از ديورتيک هاي تيازيد و آميلورايد به همراه رژيم کم سديم و مهارکننده هاي سنتز پروستاگالندين )ايندومتازين( انجام ميشود .
رژيم کم سديم باعث پاسخ جبراني بازجذب سديم و به دنبال آن آب ميشود و ميتواند تا حدي پلي اوري را برطرف کند.
در موارد partial ممکن است دوز هاي مصرفي را حتي تا ?? برابر افزايش دهيم تا پاسخ مناسب مشاهده شود.
دیدگاهها